|
3.4. Wachstum
ohne Leben: Kristalle
|
Mineralienbörsen
sind gut besuchte Veranstaltungen. Die Schönheit und Vielfalt der präsentierten
Kristallformen üben eine besondere Anziehung auf die Besucher aus. Manchem
stellen sich dabei die Fragen, woraus Mineralien aufgebaut sind und auf welche
Weise ihre Kristalle gewachsen sind.
Aufbau
der Kristalle.
Minerale wie Gips und Steinsalz im Keuper, Pyrit
(Katzengold) im Schwarzjura oder Kalkspat als Spaltenfüllung im weißen
Jurakalk der Alb bilden oft beachtliche Kristalle. Sie sind aus Ionen, das sind
elektrisch geladene Atome, aufgebaut. Solche Kristalle bezeichnet man als Ionenkristalle.
Positiv geladen sind Metall-Ionen wie die des Natriums im Salz, des Calciums im
Gips und Kalkspat sowie Eisen-Ionen im Pyrit. Als negative Ionen finden sich in
den genannten Mineralien Chlorid-Ionen im Salz, Sulfat-Ionen im Gips,
Sulfid-Ionen im Pyrit und Carbonat-Ionen im Kalkspat. Die elektrisch
entgegengesetzt geladenen Ionen ziehen sich gegenseitig an und sind deshalb im
Kristall abwechselnd angeordnet. Aus den Größenverhältnissen der
beteiligten Ionen ergibt sich die Grundform des Kristalls. Chlorid-Ionen sind
etwa doppelt so groß wie Natrium-Ionen. Jedes Natrium-Ion ist folglich von
sechs Chlorid-Ionen umgeben. Daraus ergibt sich als Grundform des Salzkristalls
ein Würfel.
Außer
Ionenkristallen gibt es noch solche, die aus regelmäßig angeordneten
elektrisch neutralen Atomen aufgebaut sind. Massen-Anziehungskräfte zwischen
den Atomen und gemeinsam genutzte Elektronen sind für den Zusammenhalt solcher Atomkristalle
bestimmend. So besteht z.B. Diamant aus Kohlenstoffatomen. Auch Schwefel,
in Spalten von Vulkanen anzutreffen, bildet Atomkristalle. Kleine
Schwefelkristalle kann man herstellen, indem man ein Streichholz unter einem
Objektträger anzündet. Unter dem Mikroskop erkennt man in dem gelblichen
Sublimat tafel- und nadelförmige Schwefelkristalle .
In Kristallen
wiederholt sich die jeweilige Grundform viele Millionen Male. Man spricht dann
von einem Kristallgitter. Dabei kann die Grundform auf verschiedene
Weise, z.B. übereinander oder treppenförmig versetzt angeordnet sein.
Verschiedene Grundformen wie Würfel, Sechseck, Tetraeder, schiefes Prisma u.a.
sowie die unterschiedlichen Möglichkeiten ihrer Anordnung erklären die
Vielfalt der Kristallformen. Je nach Anordnung seiner Atome kann z.B.
Kohlenstoff kristallisiert als Diamant oder als Graphit vorkommen.
Wachstum
von Kristallen. Man kann bisweilen Kristallbildungen von Salz am Meeresstrand
oder Ausblühungen von Salpeter an feuchtem Mauerwerk beobachten.
|

|
Salpeterlösung (Kaliumnitrat) auf einem Objektträger unter dem
Mikroskop eintrocknen zu lassen, bietet eine eindrucksvolle Möglichkeit, in
polarisiertem Licht bunte Kristallnadeln wie aus dem Nichts hervorschießen zu
sehen.
|
Meist jedoch wachsen Kristalle in der Natur in langen Zeiträumen, oft
in Jahrtausenden. Sie scheiden sich in Hohlräumen der Gesteine aus magmatischen
Gesteinsschmelzen, aus vulkanischen Gasen oder aus gesättigten Minerallösungen
allmählich ab. Je länger und ungestörter die Zeit des Wachstums ist, umso größer
sind die Kristalle. Relativ schnelle Kristallbildung, Raummangel und die
Konkurrenz von anderen Mineralen führen zu Aggregaten aus vielen kleinen
Kristallen.
Man
kann den Wachstumsvorgang an selbst gezüchteten Kristallen verfolgen, am
einfachsten an der Kristallabscheidung aus einer gesättigten Kochsalzlösung. Man
stellt dazu eine klare Kochsalzlösung an einen warmen ruhigen Ort und wartet,
bis sich infolge Verdunstung am Rand des Gefäßes eine weiße Salzkruste
bildet. In diese gesättigte Lösung hängt man nun an einem dünnen Faden ein
Kochsalzkristall. Im Verlauf einer Woche kann daraus ein ansehlicher Salzwürfel
heranwachsen.
|

|
Gibt man einen Tropfen gesättigte Salzlösung auf einen Objektträger und
betrachtet ihn unter dem Mikroskop, so kann man die Abscheidung der
Salzkristalle direkt verfolgen. In diesem Fall erfolgt mangels Zufuhr von Salz
gegen Ende des Kristallisierens Skelettwachstum um das zentrale Kristall. |
Erstaunlich
ist bei solchen Beobachtungen die Regelmäßigkeit der Kristallabscheidung. Sie
beginnt meist an einem bereits vorhandenen festen Kristallisationskeim,
in obigem Fall der hineingehängte würfelförmige Kochsalz-Impfkristall. An
dessen Flächen werden neue Kristallflächen angefügt. Ein neue Kristallfläche
beginnt ihr Wachstum erst, wenn die vorige vollständig mit Ionen aufgefüllt
wurde. Dieser Umstand lässt sich dadurch erklären, dass die elektrischen
Anziehungskräfte zwischen den kristallbildenenden Natrium- und Chlorid-Ionen
einerseits relativ groß sind, andrerseits jedoch nur auf sehr kurze atomare
Entfernungen wirken. Das erkennt man daran, dass ein zerbrochener Kristall durch
exaktes Zusammendrücken der Teile dennoch nicht mehr hält. Beim Vorgang des
Kristallwachstums zieht ein bereits abgelagertes Natrium-Ion ein nahe
befindliches Chlorid-Ion aus der Lösung an, dieses wiederum ein Natrium-Ion
usw. So wird Zeile um Zeile einer Kristallfläche aufgebaut. Danach folgt der
Aufbau der nächsten Kristallfläche. Berechnungen haben ergeben, dass z.B. auf
einer Würfelfläche von 1 cm2 etwa 4x1014 Ionen
eingeordnet werden. So
ist es verständlich, dass bei steigender Geschwindigkeit des Kristallwachstums
Störungen auftreten. So werden Ionen an falschen stellen oder sogar
Fremdteilchen eingebaut. Auch können viele Kristallisationskeime gleichzeitig
auftreten. Nur bei extrem langsamen Wachstum und unter günstigsten Bedingungen
wie Reinheit der Lösung und Temperaturkonstanz erhält man Idealkristalle . In
Realkristallen findet man infolge solcher Wachstumsstörungen Lücken,
Risse, mosaikartigen Aufbau oder mangels ausreichender Stoffzufuhr sogar
skelettartige Formen wie bei Schneekristallen.
Was
ist eigentlich der Grund dafür, dass Stoffteilchen wie Atome oder Ionen ihre
freie Beweglichkeit aus Gasen, Schmelzen oder Lösungen aufgeben, zugunsten
eines starr ins Kristallgitter eingebundenen Zustandes? In Gasen können sich
die Stoffteilchen völlig frei bewegen. Dementsprechend groß ist ihre
Bewegungsenergie und die dadurch bedingten Abstände zwischen den Teilchen. Auf
solche Entfernungen können keine Anziehungskräfte wirken, weshalb sich Gase
frei im Raum verteilen. Beim Übergang aus dem gasförmigen in den flüssigen
und dann in den festen Zustand verringert sich der Teilchenabstand und die
Anziehungskräfte werden zunehmend wirksam. Die überschüssige Bewegungsenergie
der Teilchen wird dabei als Wärme abgegeben. Der umgekehrte Vorgang, z.B. das
Schmelzen eines Stoffes erfordert dafür Energiezufuhr von außen. Energetisch
betrachtet ist also der feste Zustand besonders stabil. Je dichter die Atome
oder Ionen dabei gepackt sind, desto stärker sind die Anziehungskräfte und
umso energetisch sparsamer und stabiler ist der Teilchenverbund. Dies ist
besonders im geordneten, also kristallisierten Zustand der Fall. Wird eine
Schmelze langsam abgekühlt, so bleibt sie auch unterhalb ihrer
Erstarrungstemperatur noch flüssig. Kristallisiert die unterkühlte Schmelze,
z.B. durch Hinzufügen eines Impfkristalls, so steigt ihre Temperatur wieder an.
Beim Kristallisieren wird also Bewegungsenergie der Teilchen als Kristallisationswärme
abgegeben. Hier besteht auch der wesentliche Unterschied zwischen
Kristallwachstum und biologischen Wachstumsvorgängen. Während das
Kristallwachstum mit Energieeinsparung verbunden ist, wachsen Lebewesen nur
unter Zufuhr von Energie: Licht für grüne Pflanzen und energiereiche Nährstoffe
für Tiere und Menschen. Kristalle stellen einen ziemlich stabilen Zustand,
Lebewesen einen instabilen Zustand der Organisation der Materie dar. Energetische
Zusammenhänge der Kristallbildung kann man auf eindrucksvolle Weise beim
Abbinden von Baugips feststellen: Das Gips-Wasser-Gemisch wird beim Erhärten
richtig heiß. Ursache dafür ist das Einbinden von Kristallwasser in die
wachsenden Gipskristalle.
|
|
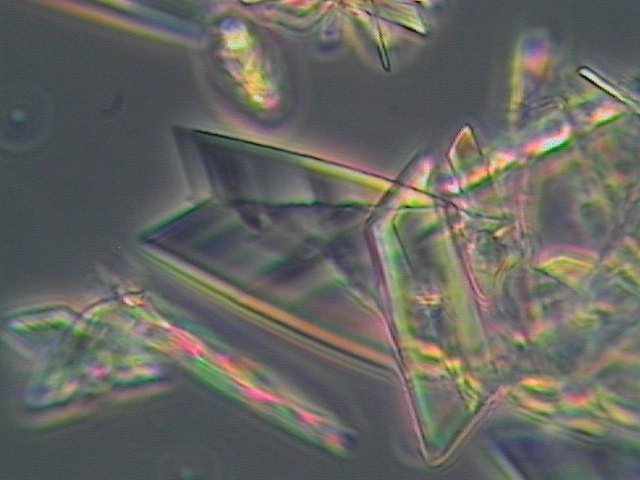
Zur mikroskopischen
Beobachtung der Kristallbildung streut man in einen Wassertropfen auf dem
Objektträger eine kleine Prise Gipspulver, legt ein Deckglas auf und dichtet
dessen Rand z.B. mit Nagellack ab. Schon nach einigen Minuten wachsen
Gipskristalle als charakteristische Schwalbenschwanz-Zwillinge.
|
|
Übrigens
ist die Annahme irrig, dass Schreibkreide aus Kreidestaub, also aus Kalk ist:
Sie besteht aus fein gemahlenem Gips. Wer’s nicht glaubt, kann den Kalktest,
Aufschäumen mit Säure, an Schreibkreide ausprobieren.
Interessant
ist auch der Einfluss äußerer Faktoren wie Druck, Temperatur oder Fremdstoffe
auf die Kristallbildung. Kocht man beispielsweise eine gesättigte
Calciumhydrogencarbonatlösung ab, so erhält man durch Entweichen von
Kohlendioxid, wie auch aus hartem Wasser nadelförmige Aragonitkristalle, meist
büschelförmig angeordnet. Sie sind es, die Wäsche beim Waschvorgang
unangenehm hart und kratzend für die Haut machen. Gibt man in die gleiche
Lösung z.B. Fadenalgen und stellt sie ans Licht, so entstehen durch
photosynthetischen Entzug von Kohlendioxid schöne rhombische
Calcitkristalle. Derselbe Stoff, nämlich Calciumcarbonat kristallisiert
entweder als Aragonit oder als Calcit.
 Zum Seitenanfang
Zum Seitenanfang
 Home
Home